状態方程式
状態方程式とは、熱力学で用いられる概念で、均質な体系の状態量(圧力P、体積V、温度Tなど)を表す物理量である。一般的な気体の状態方程式は複雑になるため、理想気体を想定した理想気体の状態方程式で理解することも多い。
状態量
状態量とは、一般に、物体の状態を表す物理量 (圧力P、体積V、温度Tなど)である。状態方程式では、状態量の間に成り立つ関係を扱う。
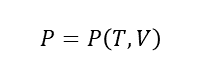
状態方程式
状態方程式とは、均質な体系の状態量である圧力P、体積V、温度Tの状態を成り立つような方程式である。

理想気体の方程式
理想気体の方程式は、下記のとおりである。圧力と体積の積と、気体の分子量と気体定数と温度の積と等しくなる。気体定数は気体の種類などに依存しない普遍の定数である。

ボイル・シャルルの法則
ボイル・シャルルの法則とは、圧力と体積、温度の関係で、これに従う気体が理想気体である。
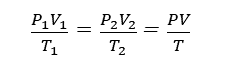
等温線
等温線は圧力と体積の積であるPVの等温変化を記述である。理想気体ではボイルの法則によりPVが一定されるため、双曲線とよばれるシンプルな形となる。普通の気体は温度によって、その形を変えるためそれぞれのケースによるグラフになる。熱力学では均質 な性質をもつ部分を相といい、気体と液体が共存する2相共存の領域という。点Cを臨界点といい、臨界点になると比熱などの物理量が異なるなど臨界現象になる。
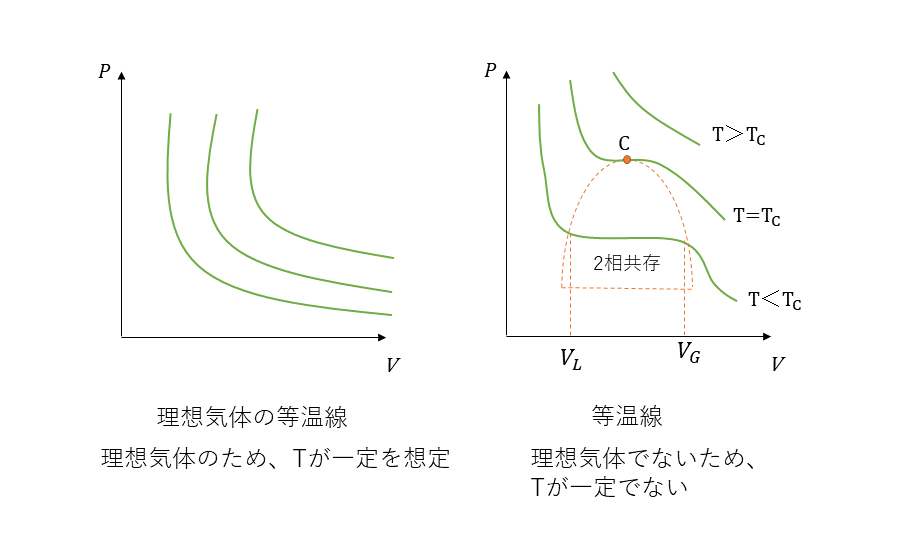
- T>Tcでは、気体をいくら圧縮しても液化しない。
- T<Tcでは、気体を圧縮したとき、BがBFに達したとき、気体の一部が液体に代わる。
- VL<V<VGでは、気体と液体が共存する。
等温圧縮率
等温圧縮率は下記で示される。

状態図
状態図(相図)とは縦軸を圧力P、横軸を温度Tとして、物質の三態を示す図をである。それぞれの節点である三重点は、気相、液相、固相が混在するする。
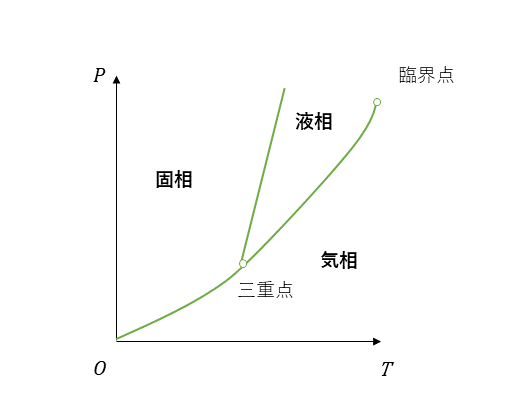
- 昇華曲線:原点Oから三重点に至る曲線
- 融解曲線:液相-固相の境界の曲線
- 気相-液相の共存曲線:三重点から臨界点までの曲線
- 飽和蒸気圧:気相-液相の共存曲線の曲線上の圧力Pがその温度で、温度によって沸点が変わる。
- 潜熱:液体が固体や気体になるとき熱の出入り