カルノーサイクルのエントロピー
カルノーサイクルは断熱過程と膨張過程を繰り返す、もっとも効率のいい熱機関であるが、エントロピーは、カルノーがカルノーサイクルを考える過程によって最初に定義づけられた。
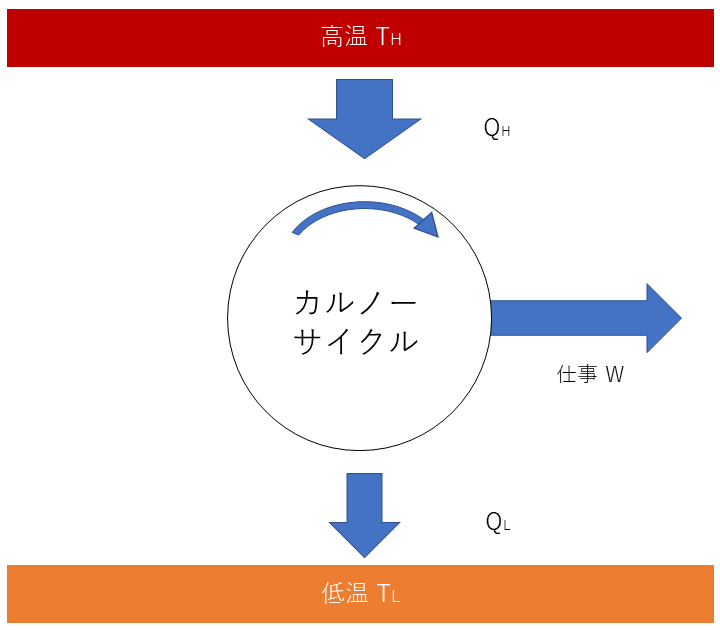
熱力学第二法則
熱力学第二法則から、熱機関は、高熱源から熱を受け取り、仕事を行った後、低熱源へ熱を放熱する。この放熱がエネルギー損失を意味し、可能な限り小さくすることで、熱効率が上がっていく。
T-S線図
カルノーサイクルにおいては、等温膨張、断熱膨張、等温圧縮、断熱圧縮の繰り返しであるので、温度TとエントロピーSで表したT-S線図は次のようになる。
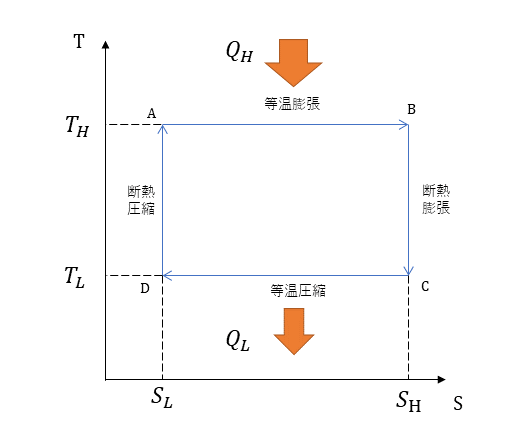
A→Bの過程:等温膨張
A→Bの過程は等温膨張の過程である。等温膨張は、熱の出入りが可能な膨張で、膨張すると内部の気体の温度は下がるが、熱が流入するため温度は一定に保たれる。なお、このときのエントロピーは、次式で表される。
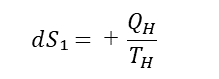
B→Cの過程:断熱膨張
B→Cの過程では、断熱膨張の過程である。完全に断熱されている状態で、気体が膨張して外部に仕事を行う。気体が膨張すると温度は低下する。なお、このときのエントロピーは、次式で表される。
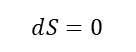
C→Dの過程:等温圧縮
C→Dの過程では、等温圧縮の過程である。等温圧縮は、熱の出入りが可能な圧縮である。圧縮すると内部の気体の温度は上がりが、熱を吐き出すため温度が一定となる。なお、この時のエントロピーは、次式になる。
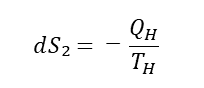
D→Aの過程:断熱圧縮
D→Aの過程では、断熱圧縮の過程である。断熱圧縮は、完全に断熱されている状態で、気体が圧縮される。気体が圧縮されると温度は上昇する。なお、このときのエントロピーは次式で表される。
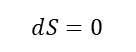
エントロピーの変化はない
QH/TH=QL/TLの関係から、dS1+ dS2=0 となるため、カルノーサイクル全体ではエントロピーの変化がないといえる。
エントロピー増加の法則
可逆サイクルにおいてはS=0となりエントロピーの増加はない。また不可逆サイクルにおいてはS>0となりエントロピーは増加する。現実はすべての過程は不可逆サイクルとなるため、エントロピーは常に増大し続けることを示しており、このことをエントロピー増加の法則という。